Propiedades de los ácidos
carboxílicos

 Los
ácidos carboxílicos son compuestos caracterizados por la presencia del
grupo carboxilo (-COOH) unido a un grupo alquilo o arilo. Cuando la cadena
carbonada presenta un solo grupo carboxilo, los ácidos se llaman
monocarboxilicos o ácidos grasos, se les denomina así ya que se obtienen por
hidrólisis de las grasas.
Los
ácidos carboxílicos son compuestos caracterizados por la presencia del
grupo carboxilo (-COOH) unido a un grupo alquilo o arilo. Cuando la cadena
carbonada presenta un solo grupo carboxilo, los ácidos se llaman
monocarboxilicos o ácidos grasos, se les denomina así ya que se obtienen por
hidrólisis de las grasas.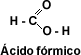 El
primer miembro de la serie alifática de los ácidos carboxílicos es el ácido
metanóico o ácido fórmico, este ácido se encuentra en la naturaleza segregado
por las hormigas al morder.
El
primer miembro de la serie alifática de los ácidos carboxílicos es el ácido
metanóico o ácido fórmico, este ácido se encuentra en la naturaleza segregado
por las hormigas al morder.
El
primer miembro del grupo aromático es el fenilmetanóico o ácido benzóico.
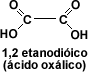
Cuando la cadena carbonada presenta dos grupos carboxilo, los ácidos se llaman
dicarboxílicos, siendo el primer miembro de la serie alifática el 1, 2
etanodíoco o ácido oxálico.
Propiedades Físicas:
 Solubilidad: El
grupo carboxilo –COOH confiere carácter polar a los ácidos y permite la
formación de puentes de hidrógeno entre la molécula de ácido carboxílico y la
molécula de agua. La presencia de dos átomos de oxígeno en el grupo carboxilo
hace posible que dos moléculas de ácido se unan entre sí por puente de
hidrógeno doble, formando un dímero cíclico.
Solubilidad: El
grupo carboxilo –COOH confiere carácter polar a los ácidos y permite la
formación de puentes de hidrógeno entre la molécula de ácido carboxílico y la
molécula de agua. La presencia de dos átomos de oxígeno en el grupo carboxilo
hace posible que dos moléculas de ácido se unan entre sí por puente de
hidrógeno doble, formando un dímero cíclico. Esto
hace que los primeros cuatro ácidos monocarboxílicos alifáticos sean líquidos
completamente solubles en agua. La solubilidad disminuye a medida que aumenta
el número de átomos de carbono. A partir del ácido dodecanóico o ácido láurico
los ácidos carboxílicos
son sólidos blandos insolubles en agua.
Esto
hace que los primeros cuatro ácidos monocarboxílicos alifáticos sean líquidos
completamente solubles en agua. La solubilidad disminuye a medida que aumenta
el número de átomos de carbono. A partir del ácido dodecanóico o ácido láurico
los ácidos carboxílicos
son sólidos blandos insolubles en agua.
En
los ácidos aromáticos monocarboxílicos, la relación carbono-carbono es de 6:1
lo que provoca que la solubilidad se vea disminuida con respecto a los ácidos
monocarboxílicos alifáticos.
 Punto
de ebullición: Los ácidos carboxílicos presentan puntos de ebullición
elevados debido a la presencia de doble puente de hidrógeno.
Punto
de ebullición: Los ácidos carboxílicos presentan puntos de ebullición
elevados debido a la presencia de doble puente de hidrógeno. Punto
de fusión: El punto de fusión varía según el número de carbonos, siendo
más elevado el de los ácidos fórmico y acético, al compararlos con los ácidos
propiónico, butírico y valérico de 3, 4 y 5 carbonos, respectivamente. Después
de 6 carbonos el punto de fusión se eleva de manera irregular.
Punto
de fusión: El punto de fusión varía según el número de carbonos, siendo
más elevado el de los ácidos fórmico y acético, al compararlos con los ácidos
propiónico, butírico y valérico de 3, 4 y 5 carbonos, respectivamente. Después
de 6 carbonos el punto de fusión se eleva de manera irregular. Esto
se debe a que el aumento del número de átomos de carbono interfiere en la
asociación entre las moléculas. Los ácidos monocarboxílicos aromáticos son
sólidos cristalinos con puntos de fusión altos respecto a los ácidos
alifáticos.
Esto
se debe a que el aumento del número de átomos de carbono interfiere en la
asociación entre las moléculas. Los ácidos monocarboxílicos aromáticos son
sólidos cristalinos con puntos de fusión altos respecto a los ácidos
alifáticos. Los
ácidos fórmico y acético (1, 2 carbonos) son líquidos de olores irritantes. Los
ácidos butíricos, valeriano y capróico (4, 5 y 6 carbonos) presentan olores
desagradables. Los ácidos con mayor cantidad de carbonos presentan poco olor..
Los
ácidos fórmico y acético (1, 2 carbonos) son líquidos de olores irritantes. Los
ácidos butíricos, valeriano y capróico (4, 5 y 6 carbonos) presentan olores
desagradables. Los ácidos con mayor cantidad de carbonos presentan poco olor..
Nombre
|
Pto. de fusión ºC
|
Pto. de ebullición ºC
|
Solubilidad gr en 100 gr de agua.
|
Ac.
metanóico
|
8
|
100,5
|
Muy
soluble
|
Ac.
etanóico
|
16,6
|
118
|
Muy
soluble
|
Ac.
propanóico
|
-22
|
141
|
Muy
soluble
|
Ac.
butanóico
|
-6
|
164
|
Muy
soluble
|
Ac.
etanodióico
|
189
|
239
|
0,7
|
Ac. propanodióico
|
135,6
|
Soluble
|
|
Ac.
fenilmetanóico
|
122
|
Soluble
|
|
Ac.
ftálico
|
231
|
250
|
O,34
|
Propiedades Químicas:
El
comportamiento químico de los ácidos carboxílicos esta determinado por el grupo
carboxilo -COOH. Esta función consta de un grupo carbonilo (C=O) y de un
hidroxilo (-OH). Donde el -OH es el que sufre casi todas las reacciones:
pérdida de protón (H+) o reemplazo del grupo –OH por otro grupo.
Constantes de acidez de algunos ácidos carboxílicos
Ácidos alifáticos
|
Ka
|
Ácidos aromáticos
|
Ka
|
Métanoico
|
17,7 x
10-5
|
Fenil-metanóico
|
6,3 x
10-5
|
Etanóico
|
1,75 x
10-5
|
Paranitrobenzóico
|
36 x 10-5
|
Propanóico
|
1,3 x
10-5
|
Metanitrobenzoico
|
32 x 10-5
|
2-metilbutanoico
|
1,68 x
10-5
|
Ortonitrobenzóico
|
670 x
10-5
|
Síntesis
de los ácidos carboxílicos
Los
ácidos carboxílicos pueden obtenerse a partir de reacciones químicas como la
oxidación de alcoholes primarios, de los compuestos alquil-bencénicos y por la
hidrólisis de nitrilos entre otras..
Oxidación
de alcoholes primarios: para obtener ácidos carboxílicos mediante esta
reacción, el alcohol primario se trata con un agente oxidante fuerte donde el
alcohol actúa como un agente reductor oxidándose hasta ácido carboxílico..
Oxidación
de los compuestos alquil-bencénicos: la oxidación de los derivados
alquil-bencénicos con mezclas oxidantes fuertes llevan a la formación de ácidos
carboxílicos.
Hidrólisis
de Nitrilos: los nitrilos se hidrolizan al ser sometidos a ebullición con
ácidos minerales o álcalis en solución acuosa, generando ácidos carboxílicos
mediante sustitución nucleofílica.
 Derivados
de los Ácidos Carboxílicos: Los derivados carboxílicos son compuestos que
presentan el grupo acilo o el grupo aroilo en los ácidos alifáticos o
aromáticos.
Derivados
de los Ácidos Carboxílicos: Los derivados carboxílicos son compuestos que
presentan el grupo acilo o el grupo aroilo en los ácidos alifáticos o
aromáticos.
Entre
los derivados de los ácidos carboxílicos se encuentran: las sales de ácido, los
ésteres, los haluros de ácidos, anhídridos de ácidos, amidas e imidas.
 Los
ésteres no presentan puentes de hidrógeno intermolecular por lo que sus
puntos de ebullición son similares a los de los alcanos de pero molecular
similar. A partir de los tres átomos de carbono, su solubilidad en agua
disminuye. Se disuelven bien en solventes orgánicos. Los más volátiles tienen
olores agradables. Se usan en perfumería y para preparar condimientos artificiales.
Los
ésteres no presentan puentes de hidrógeno intermolecular por lo que sus
puntos de ebullición son similares a los de los alcanos de pero molecular
similar. A partir de los tres átomos de carbono, su solubilidad en agua
disminuye. Se disuelven bien en solventes orgánicos. Los más volátiles tienen
olores agradables. Se usan en perfumería y para preparar condimientos artificiales. Haluros
de ácido: La mayor importancia la tienen los cloruros de ácido. El primer
miembro de la serie alifática es el cloruro de metanoilo o cloruro de formilo,
el cual es un compuesto inestable.
Haluros
de ácido: La mayor importancia la tienen los cloruros de ácido. El primer
miembro de la serie alifática es el cloruro de metanoilo o cloruro de formilo,
el cual es un compuesto inestable.
La mayoría son líquidos de bajo punto de fusión y olores irritantes. No
presentan puente de hidrógeno intermolecular, por lo que sus puntos de
ebullición son más bajos que los de los ácidos de los que se derivan.
 Anhídridos
de ácido: En este grupo sólo tiene importancia el anhídrido etanóico, que
es un compuesto polar, no presenta puente de hidrógeno intermolecular por ser
el producto de la deshidratación de dos moles de ácido carboxílico. Sus puntos
de ebullición son similares a los de los aldehídos y cetonas de peso molecular
semejante.
Anhídridos
de ácido: En este grupo sólo tiene importancia el anhídrido etanóico, que
es un compuesto polar, no presenta puente de hidrógeno intermolecular por ser
el producto de la deshidratación de dos moles de ácido carboxílico. Sus puntos
de ebullición son similares a los de los aldehídos y cetonas de peso molecular
semejante. El
primer miembro de la serie alifática es la metanamida o formamida que es
diluida a temperatura ambiente, el resto de las amidas son sólidas. Presentan
un puente de hidrógeno intermolecular por lo que sus puntos de ebullición son
altos.
El
primer miembro de la serie alifática es la metanamida o formamida que es
diluida a temperatura ambiente, el resto de las amidas son sólidas. Presentan
un puente de hidrógeno intermolecular por lo que sus puntos de ebullición son
altos.
Son
compuestos polares, lo cual junto con la formación de puente de hidrógeno con
el agua las hace solubles en esta. La solubilidad disminuye a partir de los
cinco carbonos, debido a que la relación carbono – amino es mayor que 3:1. La
etanamida y sus homólogos son excelentes solventes orgánicos.
USOS O APLICACIONES
se utilizan los ácidos carboxilicos como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.
Además se usan como antitranspirantes y como neutralizantes, tambien para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
se utilizan los ácidos carboxilicos como emulsificantes, se usan especialmente para pH bajos, debido a su estabilidad en estas condiciones.
Además se usan como antitranspirantes y como neutralizantes, tambien para fabricar detergentes biodegradables, lubricantes y espesantes para pinturas. El ácido esteárico se emplea para combinar caucho o hule con otras sustancias, como pigmentos u otros materiales que controlen la flexibilidad de los productos derivados del caucho; también se usa en la polimerización de estireno y butadieno para hacer caucho artificial. Entre los nuevos usos de los ácidos grasos se encuentran la flotación de menas y la fabricación de desinfectantes, secadores de barniz y estabilizadores de calor para las resinas de vinilo. Los ácidos grasos se utilizan también en productos plásticos, como los recubrimientos para madera y metal, y en los automóviles, desde el alojamiento del filtro de aire hasta la tapicería.
BEFEFICIOS
Y RIESGOS
 Acido Pentanoico o Acido Valerianico es la
sustancia activa de la valeriana que es buena medicina para los nervios.
Acido Pentanoico o Acido Valerianico es la
sustancia activa de la valeriana que es buena medicina para los nervios.
El Acido Etanoico o acetico es el bendito vinagre
El Acido Propanoico o Propionico
es fermentado.
NOMENCLATURA
Nombres de los
ácidos carboxílicos
|
|||
Nombre trivial
|
Nombre IUPAC
|
Estructura
|
Número de carbonos
|
Ácido metanoico
|
HCOOH
|
C1:0
|
|
Ácido etanoico
|
CH3COOH
|
C2:0
|
|
Ácido propanoico
|
CH3CH2COOH
|
C3:0
|
|
Ácido butanoico
|
CH3(CH2)2COOH
|
C4:0
|
|
Ácido pentanoico
|
CH3(CH2)3COOH
|
C5:0
|
|
Ácido hexanoico
|
CH3(CH2)4COOH
|
C6:0
|
|
Ácido heptanoico
|
CH3(CH2)5)COOH
|
C7:0
|
|
Ácido octanoico
|
CH3(CH2)6COOH
|
C8:0
|
|
Ácido nonanoico
|
CH3(CH2)7COOH
|
C9:0
|
|
Ácido decanoico
|
CH3(CH2)8COOH
|
C10:0
|
|
Ácido undecanoico
|
CH3(CH2)9COOH
|
C11:0
|
|
Ácido dodecanoico
|
CH3(CH2)10COOH
|
C12:0
|
|
Ácido tridecanoico
|
CH3(CH2)11COOH
|
C13:0
|
|
Ácido tetradecanoico
|
CH3(CH2)12COOH
|
C14:0
|
|
Ácido pentadecanoico
|
CH3(CH2)13COOH
|
C15:0
|
|
Ácido hexadecanoico
|
CH3(CH2)14COOH
|
C16:0
|
|
Ácido heptadecanoico
|
CH3(CH2)15COOH
|
C17:0
|
|
Ácido octadecanoico
|
CH3(CH2)16COOH
|
C18:0
|
|
Ácido nonadecanoico
|
CH3(CH2)17COOH
|
C19:0
|
|
Ácido eicosanoico
|
CH3(CH2)18COOH
|
C20:0
|
|
Ácido heneicosanoico
|
CH3(CH2)19COOH
|
C21:0
|
|
Ácido docosanoico
|
CH3(CH2)20COOH
|
C22:0
|
|
Ácido tricosanoico
|
CH3(CH2)21COOH
|
C23:0
|
|
Ácido tetracosanoico
|
CH3(CH2)22COOH
|
C24:0
|
|
Ácido pentacosanoico
|
CH3(CH2)23COOH
|
C25:0
|
|
Ácido hexacosanoico
|
CH3(CH2)24COOH
|
C26:0
|
|
Ácido heptacosanoico
|
CH3(CH2)25COOH
|
C27:0
|
|
Ácido octacosanoico
|
CH3(CH2)26COOH
|
C28:0
|
|
Ácido nonacosanoico
|
CH3(CH2)27COOH
|
C29:0
|
|
Ácido triacontanoico
|
CH3(CH2)28COOH
|
C30:0
|
|
Ácido henatriacontanoico
|
CH3(CH2)29COOH
|
C31:0
|
|
Ácido dotriacontanoico
|
CH3(CH2)30COOH
|
C32:0
|
|
Ácido tritriacontanoico
|
CH3(CH2)31COOH
|
C33:0
|
|
Ácido tetratriacontanoico
|
CH3(CH2)32COOH
|
C34:0
|
|
Ácido pentatriacontanoico
|
CH3(CH2)33COOH
|
C35:0
|
|
Ácido hexatriacontanoico
|
CH3(CH2)34COOH
|
C36:0
|
|
BIBLIOGRAFIA
http://www.salonhogar.net/quimica/nomenclatura_quimica/Propiedades_acidos_carboxilicos.htm
http://acidoscarboxilicosporchristiande11a.blogspot.com/p/usos-o-aplicaciones.html
http://espanol.answers.yahoo.com/question/index?qid=20090303165212AAGk9oU
http://es.wikipedia.org/wiki/%C3%81cido_carbox%C3%ADlico#Nomenclatura
http://www.exito.com/images/products/900/0000293930259900/0000293931385307_xl_a.jpg
http://www.murciasalud.es/recursos/ficheros/185253-ghb3.jpg
http://co.kalipedia.com/kalipediamedia/cienciasnaturales/media/200709/24/fisicayquimica/20070924klpcnafyq_153.Ies.SCO.jpg
http://l.yimg.com/bt/api/res/1.2/Cxn3LN83A3_0TtjyKw3.9A--/YXBwaWQ9eW5ld3M7cT04NTt3PTMwMA--/http://media.zenfs.com/es-US/blogs/comoencasablog/Vinagre.jpg
http://remediosparadormir.files.wordpress.com/2012/10/remedios-para-dormir-valeriana.jpg










No hay comentarios:
Publicar un comentario